Zawartość
-
Proteoglikany
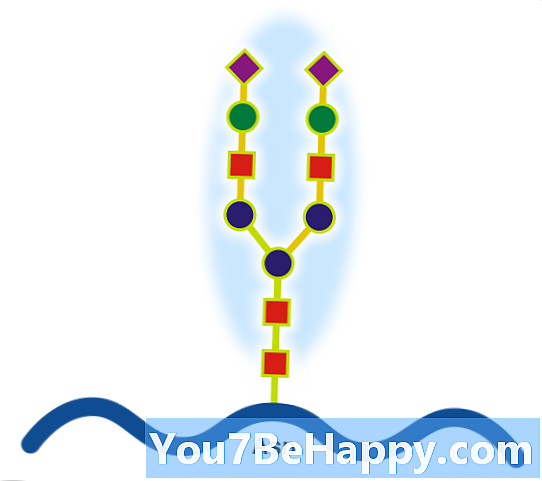
Proteoglikany to białka silnie glikozylowane. Podstawowa jednostka proteoglikanu składa się z „białka rdzeniowego” z jednym lub więcej kowalencyjnie przyłączonym łańcuchem (łańcuchami) glikozaminoglikanu (GAG). Punkt przyłączenia stanowi reszta seryny (Ser), z którą glikozaminoglikan jest połączony mostkiem tetrasacharydowym (np. Siarczan chondroityny-GlcA-Gal-Gal-Xyl-PROTEIN). Reszta Ser jest na ogół w sekwencji -Ser-Gly-X-Gly- (gdzie X może być dowolną resztą aminokwasową oprócz proliny), chociaż nie każde białko z tą sekwencją ma przyłączony glikozaminoglikan. Łańcuchy są długimi, liniowymi polimerami węglowodanowymi, które są naładowane ujemnie w warunkach fizjologicznych ze względu na występowanie grup siarczanowych i kwasowych uronowych. Proteoglikany występują w tkance łącznej.
-
Glikoproteina
Glikoproteiny to białka zawierające łańcuchy oligosacharydowe (glikany) kowalencyjnie przyłączone do łańcuchów bocznych aminokwasów. Węglowodany są przyłączone do białka w modyfikacji kotranslacyjnej lub potranslacyjnej. Ten proces jest znany jako glikozylacja. Wydzielane białka zewnątrzkomórkowe są często glikozylowane. W białkach, które mają segmenty rozciągające się zewnątrzkomórkowo, segmenty zewnątrzkomórkowe są również często glikozylowane. Glikoproteiny są również często ważnymi integralnymi białkami błonowymi, które odgrywają rolę w interakcjach między komórkami. Ważne jest, aby odróżnić glikozylację układu wydzielniczego opartą na siateczce śródplazmatycznej od odwracalnej glikozylacji cytozolowo-jądrowej. Glikoproteiny cytozolu i jądra można modyfikować poprzez odwracalne dodanie pojedynczej reszty GlcNAc, która jest uważana za odwrotną do fosforylacji, a ich funkcje prawdopodobnie będą dodatkowym mechanizmem regulacyjnym, który kontroluje sygnalizację opartą na fosforylacji. Natomiast klasyczna glikozylacja wydzielnicza może być strukturalnie niezbędna. Na przykład hamowanie glikozylacji związanej z asparaginą, tj. Związanej z N, może zapobiegać prawidłowemu fałdowaniu glikoprotein, a pełne hamowanie może być toksyczne dla pojedynczej komórki. Natomiast zaburzenie przetwarzania glikanu (enzymatyczne usuwanie / dodanie reszt węglowodanowych do glikanu), które występuje zarówno w siateczce endoplastycznej, jak i aparacie Golgiego, jest zbędne dla izolowanych komórek (jako dowód na przeżycie z inhibitorami glikozydów), ale może prowadzić do ludzi choroba (wrodzone zaburzenia glikozylacji) i może być śmiertelna w modelach zwierzęcych. Jest zatem prawdopodobne, że dokładne przetwarzanie glikanów jest ważne dla endogennej funkcjonalności, takiej jak handel komórkami, ale prawdopodobnie miało to drugorzędne znaczenie dla jej roli w interakcjach gospodarz-patogen. Znanym przykładem tego ostatniego efektu jest układ grup krwi ABO.
Proteoglikany (rzecz.)
liczba mnoga proteoglikanu
Glikoproteina
Białko z kowalencyjnie związanymi węglowodanami.
Glikoproteina
dowolna klasa białek, które mają grupy węglowodanowe przyłączone do łańcucha polipeptydowego.
Glikoproteina
skoniugowane białko zawierające składnik węglowodanowy